 |
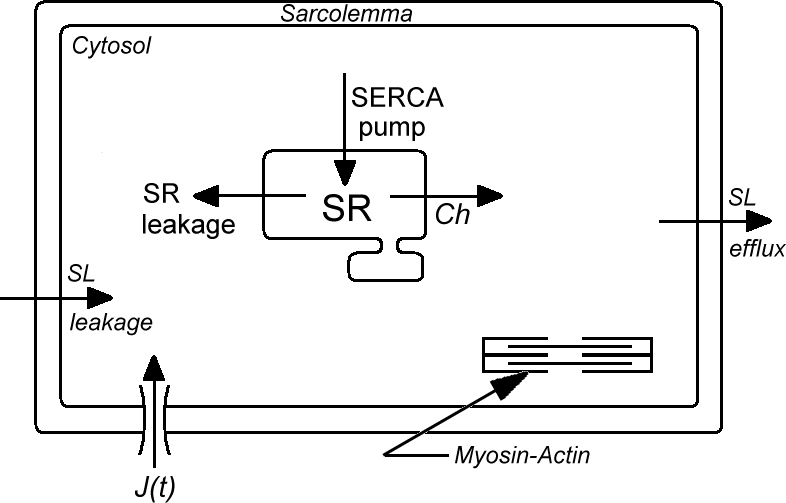
Dans les cellules cardiaques, la dynamique du Ca++ est essentielle, voire critique tant dans le métabolisme cellulaire que dans le phénomène de contraction. Elle implique de nombreux composants membranaires ainsi que des compartiments intra-cellulaires. Dans les cardiomyocytes, la dépolarisation, provoquée par stimulation électrique, amène l'entrée de Ca++ aux travers des canaux voltage dépendant dans la membrane du sarcolème. Ce flux de Ca++ induit l'ouverture de canaux Ca++ (récepteurs ryanodines) dans le réticulum sarcoplasmique (RS) d'où procède un relargage dans le compartiment cytosolique du Ca++ stocké dans le RS. La contraction, provoquée par les protéines contractiles, est déclenchée par l'augmentation du Ca++ dans le compartiment cytosolique. La relaxation suit la reprise du Ca++ par les pompes à Ca++ dans RS (pompe SERCA) ou son expulsion de la cellule essentiellement assurée par l'échangeur sodium-calcium.
Il existe des modèles décrivant la gestion du Ca++ par les composants cellulaires du cardiomyocyte. Ces modèles ne comportent pas de détermination satisfaisante des composants du RS : activité de la pompe et conductance des canaux ryanodines. De telles simplifications limitent les capacités prédictives de ces modèles en terme d'études pharmacologiques sur la dynamique du Ca++ ainsi que sur la génération d'efforts dans la cellule.
Nous avons, pour notre part, développé un modèle de gestion du Ca++ dans la cellule cardiaque après avoir déterminé les paramètres du RS, à savoir les activités respectives de la pompe SERCA et des canaux ryanodines. Cette détermination a été conduite à partir de mesures de la quantité de Ca++ libre dans le RS. Les mesures ont été faites par fluorimétrie du Ca++ dans des cellules isolées chargées avec du Mag-Fura2, puis perméabilisées avec de la digitonine. Ce protocole permet la dilution du Mag-Fura2 accumulé dans le cytosol (seul le Mag-Fura2 contenu dans les compartiments intracellulaires et essentiellement dans le RS est visualisé). De plus l'utilisation d'une sonde présentant une faible affinité avec le Ca++ libre permet la détermination de concentration de l'ordre du micro-molaire (cette concentration est cohérente avec la mesure de concentration de l'ordre du milli-molaire dans le RS mais elle le serait moins pour les mesures dans le cytosol où les concentrations sont de l'ordre de 0.1 à 1mM).
Ce projet a permis une meilleure compréhension des dynamiques cellulaires et a permis également l'établissement d'un nouveau plan d'expérience basé sur les résultats de la modélisation. Les travaux actuels sont destinés à l'extension du modèle afin de permettre une meilleure adéquation des résultats des simulations avec les résultats expérimentaux.
 |